Proteína
Origem: Wikipédia, a enciclopédia livre.

Ao contrário das plantas, os animais não conseguem sintetizar todos os aminoácidos de que necessitam para viver. Os aminoácidos que o organismo não é capaz de sintetizar por si próprio são denominados aminoácidos essenciais e devem ser obtidos pelo consumo de alimentos que contenham proteínas, as quais são transformadas em aminoácidos durante a digestão. As proteínas podem ser encontradas numa ampla variedade de alimentos de origem animal e vegetal. A carne, os ovos, o leite e o peixe são fontes de proteínas completas. Entre as principais fontes vegetais ricas em proteína estão os legumes, principalmente o feijão, as lentilhas, a soja ou o grão-de-bico. A grande maioria dos aminoácidos está disponível na dieta humana, pelo que uma pessoa saudável com uma dieta equilibrada raramente necessita de suplementos de proteínas. A necessidade é também maior em atletas ou durante a infância, gravidez ou amamentação, ou quando o corpo se encontra em recuperação de um trauma ou de uma operação. Quando o corpo não recebe as quantidades de proteínas necessárias verifica-se insuficiência e desnutrição proteica, a qual pode provocar uma série de doenças, entre as quais atraso no desenvolvimento em crianças ou kwashiorkor.
Uma proteína contém pelo menos uma cadeia polímérica linear derivada da condensação de aminoácidos, ou polipeptídeo. Os resíduos individuais de aminoácidos estão unidos entre si através de ligações peptídicas. A sequência dos resíduos de aminoácidos em cada proteína é definida pela sequência de um gene, a qual está codificada no código genético. Durante ou após o processo de síntese, os resíduos de uma proteína são muitas vezes alterados quimicamente através de modificação pós-traducional, a qual modifica as propriedades físicas e químicas das proteínas, o seu enovelamento, estabilidade, atividade e, por fim, a sua função. Nalguns casos as proteínas têm anexados grupos não peptídicos, os quais são denominados cofatores ou grupos prostéticos. As proteínas podem também trabalhar em conjunto para desempenhar determinada função, agrupando-se em complexos proteicos. As proteínas podem ser purificadas a partir de outros componentes celulares recorrendo a diversas técnicas, como a precipitação, ultracentrifugação, eletroforese e cromatografia. Entre os métodos usados para estudar a estrutura e funções das proteínas estão a imuno-histoquímica, mutagénese sítio-dirigida, ressonância magnética nuclear e espectrometria de massa.
Índice
Nutrição
As proteínas são nutrientes essenciais ao corpo humano.1 Enquanto a maior parte dos microorganismos e das plantas são capazes de biosintetizar todos os vinte aminoácidos-padrão, os animais, incluindo os seres humanos, necessitam de obter alguns dos aminoácidos a partir da dieta alimentar.2 Isto deve-se à ausência nos animais de algumas enzimas-chave que têm como função sintetizar esses aminoácidos. Os aminoácidos que o organismo não é capaz de sintetizar por si próprio são denominados aminoácidos essenciais. Os animais podem obter aminoácidos através do consumo de alimentos que contenham proteínas. As proteínas ingeridas são transformadas em aminoácidos através da digestão, a qual envolve a desnaturação da proteína através da exposição ao ácido e à hidrólise por parte de enzimas denominadas proteases. Alguns dos aminoácidos ingeridos são usados para a biosíntese proteica, enquanto outros são convertidos em glicose, através de gliconeogénese, ou entram no ciclo do ácido cítrico.3
Entre as principais fontes animais de proteína estão o leite materno, a fórmula infantil, carne, peixe, aves de criação, gema de ovo, queijo, iogurte e legumes.4
Os aminoácidos essenciais são a leucina, isoleucina, valina, lisina, treonina, triptófano, metionina, fenilalanina e histidina. Os aminoácidos não essenciais são a alanina, asparagina, ácido aspártico e ácido glutâmico. Os aminoácidos condicionalmente essenciais são a arginina, cisteína, glutamina, glicina, prolina, serina e tirosina.6 Os aminoácidos encontram-se em diversas fontes alimentares de origem animal, como a carne, leite, peixe e ovos. As proteínas estão também disponíveis através de diversas fontes vegetais: cereais integrais, legumes, incluindo os secos, soja, fruta nozes e sementes. Os vegetarianos e vegans podem obter os aminoácidos essenciais necessários através da ingestão de diversas proteínas vegetais.6
Função das proteínas no corpo
As proteínas são nutrientes essenciais ao crescimento e manutenção do corpo humano.7 Com a exceção da água, as proteínas são as moléculas mais abundantes no corpo, sendo o principal componente estrutural de todas as células, particularmente dos músculos.8 9 As proteínas são também usadas em membranas, como é o caso das glicoproteínas. Depois de serem repartidas em aminoácidos, são usadas como precursores do ácido nucleico, coenzimas, hormonas, resposta imunitária, reparação das células e outras moléculas essenciais para a vida.10 As proteínas são ainda fundamentais para a formação de células sanguíneas.11 Acredita-se que as proteínas aumentem o desempenho atlético.12 Os aminoácidos são usados na produção de tecido muscular e na reparação de tecido danificado. As proteínas só são usadas como fonte de energia quando os recursos de hidratos de carbono e lipídos no corpo diminuem.13Fontes alimentares

A carne, os ovos, o leite e o peixe são fontes de proteínas completas.15 Entre as fontes vegetais ricas em proteína estão os legumes, nozes, sementes e fruta. Os legumes têm maior concentração de aminoácidos e são fontes mais completas de proteína do que os cereais e os cereais integrais. Entre os alimentos vegetarianos com concentração de proteínas superior a 7% estão a soja, lentilhas, feijão vermelho e branco, feijão-frade, feijão-da-china, grão-de-bico, feijão-verde, tremoço, amêndoa, castanha-do-brasil, cajueiro, noz-pecã e sementes de sésamo, de abóbora, de algodão e de girassol.16
Entre os alimentos de base que constituem uma fonte pobre em proteínas estão raízes e tubérculos como o inhame, mandioca e batata-doce, os quais contêm apenas entre 0 e 2% de proteínas. A fruta, embora seja rica noutros nutrientes essenciais, é uma fonte relativamente pobre de aminoácidos. A banana-da-terra é também pobre em proteínas. Para uma alimentação saudável, os alimentos básicos com baixo teor de proteína devem ser complementados com alimentos com proteínas completas e de qualidade, sobretudo durante o desenvolvimento das crianças.17 18 19
| Fonte alimentar | Lisina | Treonina | Triptófano | Aminoácidos com enxofre |
|---|---|---|---|---|
| Legumes | 64 | 38 | 12 | 25 |
| Cereais (incl. integrais) | 31 | 32 | 12 | 37 |
| Nozes e sementes | 45 | 36 | 17 | 46 |
| Fruta | 45 | 29 | 11 | 27 |
| Animal | 85 | 44 | 12 | 38 |
Necessidades dietéticas
Existe um debate considerável sobre as necessidades relativas ao consumo de proteínas.23 24 A quantidade de proteínas necessária na dieta de determinada pessoa é determinada em grande parte pelo consumo total de energia e hidratos de carbono, pela necessidade do corpo de nitrogénio e aminoácidos essenciais, composição e massa corporal, taxa de crescimento, nível de atividade física e presença de lesões ou doenças.25 26 27 A atividade física elevada e o aumento da massa muscular aumentam a necessidade de proteínas. A necessidade é também maior durante a infância, gravidez ou amamentação, ou quando o corpo se encontra em recuperação de um trauma ou de uma operação.28| Grupo | AESA União Europeia29 |
|---|---|
| Adultos e idosos | 0,83 g/kg/dia |
| Recém-nascidos, crianças e adolescentes |
0,83 — 1,31 g/kg/dia |
| Grávidas | acréscimo de: 1º trimestre: 1 g/dia 2º trimestre: 9 g/dia 3º trimestre: 21 g/dia |
| Lactantes | acréscimo de: primeiros seis meses: 19 g/dia meses seguintes: 13 g/dia |
Consumo excessivo e insuficiência
Para compensar as variações na ingestão de proteínas ao longo do dia, ou em casos de emergência em que a ingestão de proteínas é temporariamente alta ou baixa, o corpo tenta equilibrar os níveis de proteínas recorrendo a uma reserva de curta duração.31 No entanto, o corpo é incapaz de armazenar o excesso de proteínas a longo prazo. As proteínas são digeridas em aminoácidos que entram na corrente sanguínea. Os aminoácidos em excesso são convertidos pelo fígado em moléculas úteis, num processo denominado desaminação. A desaminação converte o nitrogénio dos aminoácidos em amónia, a qual é por sua vez convertida pelo fígado em ureia durante o ciclo da ureia. A ureia é depois excretada pelos rins.25 32O consumo excessivo de proteínas provoca também o aumento da excreção de cálcio na urina, o que se pensa ser devido ao desequilíbrio no pH, agravando o risco da formação de cálculos no sistema urinário.31 Um estudo epidemiológico de 2006 não verificou a existência de qualquer relação entre o consumo total de proteína e a pressão arterial, embora tenha verificado uma relação inversa entre o consumo de proteína vegetal e a pressão arterial.33
Quando o corpo não recebe as quantidades de proteínas necessárias verifica-se insuficiência e desnutrição proteica, a qual pode provocar uma série de doenças, entre as quais atraso no desenvolvimento em crianças, kwashiorkor, pigmentação avermelhada do cabelo e da pele, fígado gorduroso, diarreia, dermatose e diminuição na contagem de linfócitos T, o que aumenta o risco de infeções secundárias.34 35 A desnutrição proteica é relativamente comum à escala mundial, tanto em adultos como crianças, e é responsável por cerca de seis milhões de mortes anualmente. Nos países desenvolvidos, esta doença verifica-se predominantemente em idosos ou em hospitais, geralmente associada a outras doenças.36
Bioquímica

A ligação peptídica tem duas formas de ressonância que contribuem para a formação de uma ligação dupla e inibem a rotação em torno do seu próprio eixo, pelo que os carbonos alfa são aproximadamente coplanares. Os outros dois ângulos diedros na ligação peptídica determinam a forma assumida pela cadeia principal.40 A extremidade da proteína com um grupo carboxílico livre é denominada C-terminal ou carboxi-terminal, enquanto a extremidade com um grupo livre de amina é denominada N-terminal ou amino-terminal. Os termos "proteína", "polipetídeo" e "peptídeo" são ligeiramente ambíguas e o seu significado pode-se sobrepôr. "Proteína" é geralmente usado para nos referirmos à molécula biológica completa na sua forma terciária estável, enquanto "peptídeo" está geralmente reservado para oligómeros curtos de aminoácidos, aos quais muitas vezes falta uma estrutura tridimensional estável. No entanto, a diferença entre ambos não é bem definida e geralmente corresponde a 20-30 resíduos. "Polipetídeo" pode ser referente a qualquer cadeia linear de aminácidos, independentemente do comprimento, mas onde geralmente não existe uma forma terciária.41
Síntese
Biossíntese
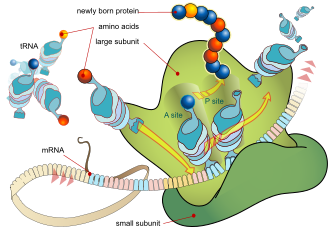
O processo de síntese de uma proteína a partir de um molde de ARNm é denominado tradução. O ARNm é carregado no ribossoma, no qual são lidos três nucleótidos de cada vez. A leitura é feita fazendo corresponder cada codão com o seu anticodão situado numa molécula de ARN transportador (ARNt), a qual transporta o aminoácido correspondente ao codão por si reconhecido. A enzima aminoacil-tRNA sintetase carrega as moléculas de ARNt com o aminoácido correto. As proteínas são sempre sintetizadas a partir do N-terminal em direção ao C-terminal.44
O tamanho de uma proteína sintetizada pode ser medido através do número de aminoácidos e da sua massa molecular total, valor que é geralmente expresso em daltons (Da), sinónimo de unidade de massa atómica. As proteínas das leveduras, por exemplo, têm em média um comprimento de 466 aminoácidos e 53 kDa de massa.45 As maiores proteínas conhecidas são as titinas, com quase 3000 kDA de massa molecular de 27 000 aminoácidos de comprimento.46
Síntese química
As proteínas curtas podem também ser sintetizadas quimicamente através de uma série de métodos denominados síntese de peptídeos, os quais têm por base técnicas de síntese orgânica de elevado rendimento na produção de peptídeos.47 A síntese química permite a introdução de aminoácidos não naturais nas cadeias de peptídeos.48 Estes métodos são úteis em laboratórios de bioquímica e biologia celular, embora não se adequem à produção comercial. A síntese química não é eficiente para polipeptídeos maiores do que 300 aminoácidos, e as proteínas sintetizadas podem não assumir imediatamente a sua estrutura terciária nativa. Grande parte dos métodos de síntese química realiza-se a partir do C-terminal em direção ao N-terminal, ao contrário da reação biológica natural.49Estrutura

As proteínas não são moléculas completamente rígidas. Para além destes níveis estruturais, as proteínas podem alternar entre várias estruturas enquanto desempenham as suas funções. No contexto destas alterações funcionais, estas estruturas terciárias ou quaternárias são muitas vezes denominadas "conformações", e as transições entre cada uma delas são denominadas "alterações conformacionais". Estas alterações são frequentemente induzidas pela ligação de uma molécula substrato ao sítio ativo de uma enzima – a região física da proteína que participa na catálise química.53

- Estrutura primária
- Estrutura secundária
- alfa-hélice: presente na estrutura secundária dos níveis de organização das proteínas. São estruturas cilindricas estabilizadas por pontes de hidrogénio entre aminoácidos. As cadeias laterais dos aminoácidos encontram-se viradas para fora. Existem várias formas de como as hélice alfa podem organizar-se. Na alfa-hélice a espinha dorsal polipeptídica é torcida numa hélice virada à direita.56
- folha-beta: padrão estrutural encontrado em várias proteínas, nas quais regiões vizinhas da cadeia polipeptídica associam-se por meio de ligações de hidrogénio, resultando numa estrutura achatada e rígida. Esta é também uma estrutura estável na qual os grupos polares da cadeia polipeptídica associam-se por meio de ligações de hidrogénio um ao outro.56
- laços: são secções da sequência que se ligam aos outros dois tipos de estrutura secundária. Em contraste com hélices e folhas, que formam o núcleo da proteína, laços não são estruturas regulares e ficam fora da proteína dobrada.58
- Estrutura terciária
- Estrutura quaternária
Determinação da estrutura
A descoberta da estrutura terciária de uma proteína, ou da estrutura quaternária dos seus complexos, pode fornecer dados importantes acerca da forma como a proteína realiza a sua função. Entre os métodos mais comuns para determinar a estrutura estão a cristalografia de raios X e a ressonância magnética nuclear de proteínas (RMN), ambas capazes de produzir dados à escala atómica. No entanto, a RMN pode disponibilizar dados a partir dos quais é possível determinar as distâncias entre subconjuntos de pares de átomos, permitindo assim determinar todas as conformações finais possíveis de determinada proteína. A interferometria de dupla polarização é um método analítico que permite medir a conformação e as alterações conformacionais das proteínas em função de interações ou de outros estímulos. O dicroísmo circular é outra técnica laboratorial que permite determinar a composição das proteínas a nível de hélices e folhas beta. A crio-microscopia eletrónica (crio-EM) é usada para produzir informação de baixa resolução sobre complexos proteicos de grande dimensão, entre os quais vírus.62 Uma variante denominada cristalografia eletrónica é, nalguns casos, capaz de produzir informação de elevada resolução, em particular nos cristais bidimensionais de proteínas membranares.63As estruturas resolvidas são geralmente acrescentadas ao Protein Data Bank (PDB), um recurso disponível gratuitamente que permite consultar os dados estruturais de milhares de proteínas.64 Conhece-se um número muito maior de sequências genéticas do que estruturas proteicas. Além disso, o conjunto de estruturas resolvidas tende a focar-se naquelas que podem ser facilmente adequadas às condicionantes da cristalografia de raio X. As proteínas globulares, em particular, são as mais fáceis de preparar para a cristalografia de raio X, enquanto as proteínas membranares são difíceis de cristalizar e comparativamente pouco representadas no PDB.65 As iniciativas de genómica estrutural têm vindo a tentar corrigir esta assimetria através da resolução sistemática das estruturas representativas das principais classes de enovelamento. Para além disso, existem ainda métodos de previsão de estruturas proteicas que tentam fornecer uma estrutura plausível para proteínas cujas estruturas ainda não foram determinadas experimentalmente.66
Funções celulares

A principal característica das proteínas, a qual também permite que exerçam um conjunto alargado de funções, é a sua capacidade de ligarem a si outras moléculas, de forma estável e específica. A região da proteína responsável pela agregação de outras moléculas é denominada sítio de ligação, a qual geralmente corresponde a uma depressão na superfície molecular da proteína. Esta capacidade de ligação é mediada pela estrutura terciária da proteína, a qual define a região de ligação, e pelas propriedades químicas das cadeias de aminoácidos laterais. As ligações proteicas podem ser extremamente específicas; por exemplo, a proteína inibidora da ribonuclease liga-se à angiogenina humana, mas não se liga à sua homóloga anfíbia rampirnase. Há variações químicas extremamente subtis que, por vezes, podem ser o suficiente para eliminar por completo a possibilidade de ligação proteica; por exemplo, o aminoacil-tRNA sintetase específico do aminoácido valina não é capaz de se ligar à cadeia lateral do aminoácido isoleucina, muito similar.69
As proteínas podem-se ligar não só a outras proteínas, como também a substratos de pequenas moléculas. Quando as proteínas se ligam especificamente a outras cópias da mesma molécula, são capazes de se oligomerizar para formar fibrilas. Este processo ocorre frequentemente em proteínas estruturais constituídas por monómeros globulares que se associam entre si para formar fibras rígidas. As interações entre proteínas regulam também a atividade enzimática, controlam a progressão ao longo do ciclo celular e permitem a formação de complexos proteicos que desempenham diversas reações no âmbito de uma mesma função biológica. As proteínas também se ligam a membranas celulares. A capacidade de ligarem a si parceiros que induzem alterações conformacionais nas proteínas permite a construção de redes de sinalização celular extremamente complexas.70 Uma vez que as interações entre proteínas são reversíveis, e dependem da disponibilidade de diferentes grupos de proteínas para formar agregados capazes de desempenhar um conjunto alargado de funções, o estudo das interações entre proteínas específicas é fundamental para compreender aspetos importantes da função celular e, por fim, as propriedades que distinguem diferentes tipos de células.71
Enzimática
Proteínas estruturais
As proteínas estruturais conferem rigidez a componentes biológicos que, de outra forma, seriam apenas fluidos. A maior parte das proteínas estruturais são proteínas fibrilares; por exemplo, o colagénio e a elastina são componentes fundamentais do tecido conjuntivo, como a cartilagem, enquanto a queratina está presente em estruturas duras como o cabelo, unhas, penas, cascos e algumas carapaças animais.75 Algumas proteínas globulares podem também desempenhar funções estruturais; por exemplo, a actina e a tubulina são globulares e solúveis enquanto monómeros, mas são capazes de se polimerizar nas fibras rígidas e longas que formam o citoesqueleto, o qual permite à célula manter a sua forma e tamanho. Outras proteínas que têm funções estruturais são as proteínas motoras como a miosina, cinesina e a dineína, as quais são capazes de gerar força mecânica, como a que contrai os músculos. Estas proteínas são cruciais para a motilidade de organismos unicelulares e dos espermatozoides dos organismos multicelulares que se reproduzem através de reprodução sexuada.76Sinalização celular e proteínas ligantes

Os anticorpos são componentes proteicos do sistema imunitário adquirido, cuja função principal é ligar a si antigénios ou outras substâncias estranhas ao corpo, marcando-os para serem destruídos. Os anticorpos podem ser segregados para o ambiente extracelular ou ancorados nas membranas de linfócitos B especializados, denominados plasmócitos. Enquanto as enzimas são extremamente limitadas na sua capacidade de ligação, resumindo-se aos substratos necessários para realizar a sua função enzimática, os anticorpos não têm esta restrição, apresentando uma afinidade extremamente elevada.78
Muitas das proteínas que transportam ligantes são capazes de ligar a si pequenas biomoléculas, transportando-as para diferentes locais do corpo. Estas proteínas devem ter uma elevada afinidade de ligação nos casos em que o seu ligante esteja presente em elevada concentração, mas serem também capazes de libertar o ligante nos casos em que a sua concentração nos tecidos-alvo seja diminuta. O exemplo canónico de uma proteína ligante é a hemoglobina, a qual transporta o oxigénio dos pulmões para os restantes órgãos e tecidos em todos os vertebrados e tem homólogos em todos os reinos.79 As proteínas transmembranares atuam também enquanto proteínas transportadoras de ligantes, capazes de alterar a permeabilidade da membrana celular em relação a pequenas moléculas e a iões. A própria membrana tem um núcleo hidrófugo, através do qual as moléculas polarizadas ou carregadas eletrónicamente não são capazes de se difundir. As proteínas membranares possuem canais internos que permitem a este tipo de moléculas entrar e sair da célula. Muitas proteínas com canais iónicos são especializadas no sentido de selecionar apenas um ião em particular; por exemplo, os canais de potássio e sódio são muitas vezes aceitam apenas um dos dos dois iões.80
Métodos de estudo
As proteínas são uma das moléculas biológicas mais intensivamente estudadas, quer in vitro, in vivo ou in silico. O estudo in vitro de proteínas purificadas em ambiente controlado é útil na aprendizagem da forma como as proteínas desempenham as suas funções; por exemplo, o estudo da cinética enzimática explora o mecanismo químico da atividade catalítica de uma enzima e a sua afinidade relativa em relação às possíveis moléculas substrato. Por outro lado, as experiências in vivo podem fornecer dados sobre o papel fisiológico da proteína no contexto de uma célula ou de um organismo. O estudo in silico recorre a métudos computacionais para estudar proteínas.Purificação de proteínas
No caso das proteínas naturais, podem ser necessárias mais etapas no processo de purificação de forma a obter proteínas suficientemente puras para serem usadas em laboratório. Para simplificar este processo, recorre-se muitas vezes a engenharia genética para acrescentar às proteínas características químicas que as tornem mais fáceis de serem purificadas sem, no entanto, afetar a sua estrutura ou atividade. Neste caso, a um dos terminais da proteína é acrescentada uma etiqueta constituída por uma sequência de aminoácidos específica, geralmente uma série de resíduos de histidina (etiqueta de poli-histidina). Desta forma, quando o lisado é passado sobre uma coluna de cromatografia contendo níquel, os resíduos de histidina ligam-se com o níquel e agarram-se à coluna, enquanto os componentes do lisado sem a etiqueta passam sem entraves. Têm vindo a ser desenvolvidas diversas etiquetas de modo a auxiliar os investigadores na purificação de proteínas a partir de misturas complexas.83
Localização celular
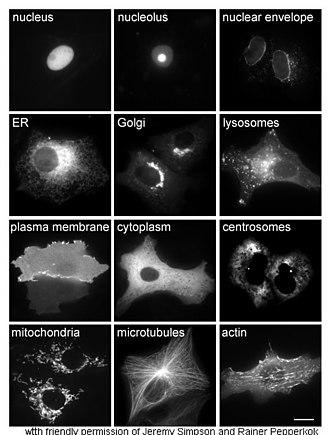
Outros métodos para obtenção da localização celular de proteínas requerem o uso de marcadores compartimentais conhecidos para diversas regiões celulares. Com o uso de versões destes marcadores etiquetadas com fluorescência, torna-se mais simples a identificação e localização da proteína pretendida.86
A técnica padrão para localização celular é a microscopia imunoeletrónica. Esta técnica usa um anticorpo para a proteína pretendida, a par de técnicas clássicas de microscopia eletrónica. A amostra é preparada para uma análise microscópica padrão, sendo depois tratada com um anticorpo dessa proteína que é conjugado com um material eletro-denso, geralmente ouro.87 Através de mutagénese sítio-dirigida, os investigadores podem alterar a sequência proteica, alterando dessa forma a sua estrutura, localização celular e suscetibilidade à regulação. Esta técnica permite ainda a incorporação nas proteínas de aminoácidos não naturaus, usando ARNt modificado,88 podendo ainda permitir a conceção de novas proteínas com novas proriedades.89
Proteómica e bioinformática
O conjunto total de proteínas presentes numa célula em determinado momento é denominado proteoma, e o estudo em grande escala destes conjuntos define o campo da proteómica, assim denominado em analogia ao campo relacionado da genómica. Entre as principais técnicas da proteómica estão a eletroforese bidimensional,90 a qual permite a separação de um vasto número de proteínas, a espectrometria de massa,91 a qual permite a rápida identificação de proteínas e sequenciação de peptídeos, o microarranjo de proteínas,92 que permite a deteção dos níveis relativos do grande número de proteínas presentes na célula, e o sistema de duplo híbrido, que permite a exploração sistemática de interações proteína-proteína.93 O conjunto total e biologicamente possível destas interações é denominado interactoma.94 O esforço sistemático para determinar as estruturas de proteínas e de todos os enovelamentos possíveis é denominado genómica estrutural.95Previsão e simulação da estrutura

Os processos de enovelamento e ligação proteica podem ser simulados usando técnicas como a dinâmica molecular ou o método de Monte Carlo, os quais têm vindo cada vez mais a tirar partido da computação distribuída, como o projeto Folding@home.98 O enovelamento de pequenos domínios proteicos de alfa-hélice, como a proteína acessória do VIH, tem vindo a ser simulado com sucesso in silico.99 Os métodos híbridos que combinam dinâmica molecular com cálculo de mecânica quântica têm permitido a exploração dos estados eletrónicos das rodopsinas.100
História e etimologia
As proteínas foram pela primeira vez descritas pelo químico holandês Gerardus Johannes Mulder e assim batizadas pelo químico sueco Jöns Jacob Berzelius em 1838. Mulder levou a cabo análises elementares de proteínas vulgares e constatou que praticamente todas as proteínas apresentavam a mesma fórmula empírica – C400H620N100O120P1S1. Ainda que erradamente, concluiu que as proteínas deveriam ser constituídas por um único tipo de molécula de grande dimensão.101 O termo "proteína" para descrever estas moléculas foi proposto pelo sócio de Mulder, Berzelius. Proteína deriva da palavra grega πρωτεῖος (proteios), a qual significa "na liderança" ou "a que está à frente".102 Mulder prossegui a investigação, identificando produtos da degradação proteica, como o aminoácido leucina, para o qual determinou o peso molecular quase preciso de 131 Da.103Os cientistas pioneiros no campo da nutrição, como o alemão Carl von Voit, acreditavam que a proteína era o mais importante nutriente na manutenção da estrutura corporal, uma vez que existia a crença generalizada de que seria a carne tinha origem na própria carne.104 Karl Heinrich Ritthausen alargou o campo das proteínas conhecidas com a identificação do ácido glutâmico. Thomas Burr Osborne compilou em 1909 uma revisão detalhada de todas as proteínas vegetais e, no mesmo ano e em conjunto com Lafayette Mendel, determinou os aminoácidos essenciais à sobrevivência de ratos de laboratório aplicando a lei de Liebig. A compreensão das proteínas enquanto polipetídeos foi proporcionada por Franz Hofmeister e Hermann Emil Fischer. O papel central das proteínas enquanto enzimas nos organismos vivos foi determinado em 1926, quando James Batcheller Sumner demonstrou que a urease era de facto uma proteína.105
A dificuldade em purificar proteínas em grande quantidade dificultou imenso a investigação dos primeiros bioquímicos. Assim, a investigação inicial focou-se sobretudo em proteínas que podiam ser facilmente purificadas em quantidade, como as do sangue, da clara de ovo, diversas toxinas e enzimas digestivas obtidas em matadouros.106 Atribiu-se a Linus Pauling a primeira previsão bem-sucedida de de estruturas secundárias de proteínas com base nas ligações de hidrogénio, uma ideia que já tinha sido proposta em 1933 por William Astbury.107 Posteriormente, a investigação de Walter Kauzmann sobre a desnaturação, baseada em parte nos estudos anteriores de Kaj Ulrik Linderstrøm-Lang, veio a contribuir para a compreensão do enovelamento de proteínas e das estruturas mediadas por interações hidrófugas.108 109 110 A primeira proteína a ser sequenciada foi a insulina, por Frederick Sanger em 1949. Sanger determinou corretamente a sequência de aminoácidos da proteína, demonstrando de forma conclusiva que as proteínas eram constituídas por polímeros lineares de aminoácidos, em vez de cadeias ramificadas ou coloides.111
As primeiras estruturas proteicas a serem resolvidas foram as da hemoglobina e da mioglobina, por Max Perutz e John Kendrew, respetivamente, em 1958.112 113 Nas décadas posteriores, a crio-microscopia eletrónica de grandes conjuntos macromoleculares e a previsão computacional de estruturas proteicas de pequenos domínios foram métodos que permitiram a investigação de proteínas à escala atómica.114 115 No início de 2014, estavam registadas no Protein Data Bank aproximadamente 90 000 estruturas proteicas com resolução atómica.116 ]
Referências
- Hermann 1995
- Voet 2004
- Brosnan 2003
- USDA 2009, p. 192
- Genton 2010, pp. 413-423
- Evert 2009
- Genton 2010, pp. 413-423
- Hermann 1995
- Food and Nutrition Board 2005
- Food and Nutrition Board 2005
- Hermann 1995
- IOC 2003
- IOC 2003
- Vernon 1994
- Steinke 1992, pp. 91–100
- Vernon 1994
- Hermann 1995
- FAO 1985
- Latham 1997
- Vernon 1994
- FAO 1985
- FAO 1985
- Bilsborough 2006, pp. 129–152
- Lemon 2000, pp. 513-521
- Tarnopolsky 1992, pp. 1986-95
- Genton 2010, pp. 413-423
- Lemon 2008, pp. S39–61
- 2007
- EFSA 2012
- Institute of Medicine 2005
- Food and Nutrition Board 2005
- Ten Have 2007
- Elliott 2006, pp. 79-87
- Latham 1997
- USDA 2009, p. 192
- Otten 2006
- Nelson 2005
- Gutteridge 2005
- Murray 2006, p. 19
- Murray 2006, p. 31
- Lodish 2004
- vanHolde 1996
- Pain 2000
- Van Holde 1996, pp. 1002-1042
- Lodish 2004
- Fulton 1991
- Bruckdorfer 2004
- Schwarzer 2005
- Kent 2009
- Murray 2006, pp. 30-34
- Murray 2006, p. 37
- Alphey 1997, p. 179
- Van Holde 1996, pp. 368-375
- Van Holde 1996, pp. 165-185
- Karp 2008, pp. 49-64
- Sharma 2009, pp. 2-6
- Berg 2002
- Setubal 1997, pp. 252-253
- IUPAC 1997
- biology-online.org s. d.
- biology-online.org s. d. b
- Branden 1999, pp. 340-341
- Gonen 2005
- Stanley 2008
- Walian 2004
- Sleator 2012
- Lodish 2004
- Voet 2004
- Sankaranarayanan 2001
- Van Holde 1996, pp. 830–49
- Samarin 2009
- Bairoch 2000
- Radzicka 1995
- EBI 2010
- Van Holde 1996, pp. 178-81
- Van Holde 1996, pp. 258-264, 272
- Branden 1999, pp. 251–81
- Van Holde 1996, pp. 247–250
- Van Holde 1996, pp. 220–229
- Branden 1999, pp. 232-34
- Murray 2006, pp. 21-24
- Hey 2008
- Terpe 2003
- Stepanenko 2008
- Yuste 2005
- Margolin 2000
- Mayhew 2008
- Hohsaka 2002
- Cedrone 2000
- Gorg 2008
- Conrotto 2008
- Joos 2009
- Koeg 2007
- Plewczynski 2009
- Zhang 2003
- Zhang 2008
- Xiang 2006
- Scheraga 2007
- Herges 2005
- Hoffman 2006
- Perrett 2007
- Reynolds 2003
- Perrett 2007
- Bischoff 1860
- Sumner 1926
- Perrett 2007
- Pauling 1951
- Kalman 1955
- Kauzmann 1956
- Kauzmann 1959
- Sanger 1949
- Muirhead 1963
- Kendrew 1958
- Zhou 2008
- keskin 2008
- RCSB s. d.
Bibliografia
- Alphey, Luke. DNA Sequencing: From Experimental Methods to Bioinformatics (em inglês). New York: Springer, 1997. Capítulo: 17: Protein Structure Prediction. p. 179. ISBN 0-387-91509-5
- Bilsborough, Shane; Neil Mann. (2006). "A Review of Issues of Dietary Protein Intake in Humans" (16).
- Bischoff, TLW. Die Gesetze der Ernaehrung des Pflanzenfressers durch neue Untersuchungen festgestellt (em German). Leipzig, Heidelberg: [s.n.], 1860.
- Brosnan, J. (June 2003). "Interorgan amino acid transport and its regulation". Journal of Nutrition 133 (6 Suppl 1): 2068S–72S. PMID 12771367.
- Bruckdorfer, T. (2004). "From production of peptides in milligram amounts for research to multi-tons quantities for drugs of the future". Current Pharmaceutical Biotechnology 5 (1): 29–43. DOI:10.2174/1389201043489620. PMID 14965208.
- Cedrone, F. (2000). "Tailoring new enzyme functions by rational redesign". Current Opinion in Structural Biology 10 (4): 405–10. DOI:10.1016/S0959-440X(00)00106-8. PMID 10981626.
- Conrotto, P. (2008). "Proteomic approaches in biological and medical sciences: principles and applications". Experimental Oncology 30 (3): 171–80. PMID 18806738.
- Copland, JA. (2009). "Sex steroid receptors in skeletal differentiation and epithelial neoplasia: is tissue-specific intervention possible?". BioEssays: news and reviews in molecular, cellular and developmental biology 31 (6): 629–41. DOI:10.1002/bies.200800138. PMID 19382224.
- Bairoch, A. (2000). "The ENZYME database in 2000". Nucleic Acids Research 28 (1): 304–305. DOI:10.1093/nar/28.1.304. PMID 10592255.
- Fernández. (2003). "Dehydron: a structurally encoded signal for protein interaction". Biophysical Journal 85 (3): 1914–28. DOI:10.1016/S0006-3495(03)74619-0. PMID 12944304. Bibcode: 2003BpJ....85.1914F.
- Fulton, A. (1991). "Titin, a huge, elastic sarcomeric protein with a probable role in morphogenesis". BioEssays 13 (4): 157–61. DOI:10.1002/bies.950130403. PMID 1859393.
- Gonen, T. (2005). "Lipid-protein interactions in double-layered two-dimensional AQP0 crystals". Nature 438 (7068): 633–38. DOI:10.1038/nature04321. PMID 16319884. Bibcode: 2005Natur.438..633G.
- Görg, A. (2004). "Current two-dimensional electrophoresis technology for proteomics". Proteomics 4 (12): 3665–85. DOI:10.1002/pmic.200401031. PMID 15543535.
- Gutteridge, A coauthor=Thornton JM. (2005). "Understanding nature's catalytic toolkit". Trends in Biochemical Sciences 30 (11): 622–29. DOI:10.1016/j.tibs.2005.09.006. PMID 16214343.
- Herges, T. (2005). "In silico folding of a three helix protein and characterization of its free-energy landscape in an all-atom force field". Physical Review Letters 94 (1). DOI:10.1103/PhysRevLett.94.018101. PMID 15698135. Bibcode: 2005PhRvL..94a8101H.
- Hey, J. (2008). "Fractionation of complex protein mixtures by liquid-phase isoelectric focusing". Methods in Molecular Biology 424: 225–39. DOI:10.1007/978-1-60327-064-9_19. PMID 18369866.
- Hoffmann, M. (2006). "Color tuning in rhodopsins: the mechanism for the spectral shift between bacteriorhodopsin and sensory rhodopsin II". Journal of the American Chemical Society 128 (33): 10808–18. DOI:10.1021/ja062082i. PMID 16910676.
- Hohsaka, T. (2002). "Incorporation of non-natural amino acids into proteins". Current Opinion in Chemical Biology 6 (6): 809–15. DOI:10.1016/S1367-5931(02)00376-9. PMID 12470735.
- IUPAC. In: A. D. McNaught, A. Wilkinson.. Compendium of Chemical Terminology. 2ª ed. Oxford: Blackwell Scientific Publications, 1997. ISBN 0-9678550-9-8.
- Joos T, Bachmann J. (2009). "Protein microarrays: potentials and limitations". Frontiers in Bioscience 14 (14): 4376–85. DOI:10.2741/3534. PMID 19273356.
- Kalman SM, Linderstrom-Lang K, Ottesen M, Richards FM. (1955). "Degradation of ribonuclease by subtilisin". Biochimica et Biophysica Acta 16 (2): 297–99. DOI:10.1016/0006-3002(55)90224-9. PMID 14363272.
- Karp, Gerald. Cell and Molecular Biology: Concepts and Experiments (em inglês). 5ª ed. Nova Jérsia: John Wiley, 2008. ISBN 978-0-470-04217-5
- Kauzmann W. (1956). "Structural factors in protein denaturation". Journal of Cellular Physiology. Supplement 47 (Suppl 1): 113–31. DOI:10.1002/jcp.1030470410. PMID 13332017.
- Kauzmann, W. (1959). "Some factors in the interpretation of protein denaturation". Advances in Protein Chemistry 14: 1–63. DOI:10.1016/S0065-3233(08)60608-7. PMID 14404936.
- Kendrew, J. (1958). "A three-dimensional model of the myoglobin molecule obtained by X-ray analysis". Nature 181 (4610): 662–66. DOI:10.1038/181662a0. PMID 13517261. Bibcode: 1958Natur.181..662K.
- Kent, SB. (2009). "Total chemical synthesis of proteins". Chemical Society Reviews 38 (2): 338–51. DOI:10.1039/b700141j. PMID 19169452.
- Keskin, O. (2008). "Characterization and prediction of protein interfaces to infer protein-protein interaction networks". Current Pharmaceutical Biotechnology 9 (2): 67–76. DOI:10.2174/138920108783955191. PMID 18393863.
- Koegl, M. (2007). "Improving yeast two-hybrid screening systems". Briefings in Functional Genomics & Proteomics 6 (4): 302–12. DOI:10.1093/bfgp/elm035. PMID 18218650.
- Kuhlman, B. (2003). "Design of a novel globular protein fold with atomic-level accuracy". Science 302 (5649): 1364–68. DOI:10.1126/science.1089427. PMID 14631033. Bibcode: 2003Sci...302.1364K.
- Lemon, Peter. (2000). "Beyond the Zone: Protein Needs of Active Individuals" 19. DOI:10.1080/07315724.2000.10718974. PMID 11023001.
- Lemon, PW. (2008). "Do athletes need more dietary protein and amino acids?". Int J Sport Nutr. 5 Suppl. PMID 7550257.</ref>
- Lodish, H. Molecular Cell Biology. 5th ed. New York, New York: WH Freeman and Company, 2004.
- Margolin, W. (2000). "Green fluorescent protein as a reporter for macromolecular localization in bacterial cells". Methods (San Diego, Calif.) 20 (1): 62–72. DOI:10.1006/meth.1999.0906. PMID 10610805.
- Mayhew, TM. (2008). "Developments in cell biology for quantitative immunoelectron microscopy based on thin sections: a review". Histochemistry and Cell Biology 130 (2): 299–313. DOI:10.1007/s00418-008-0451-6. PMID 18553098.
- Muirhead, H. (1963). "Structure of hemoglobin. A three-dimensional fourier synthesis of reduced human hemoglobin at 5.5 Å resolution". Nature 199 (4894): 633–38. DOI:10.1038/199633a0. PMID 14074546. Bibcode: 1963Natur.199..633M.
- Nelson, DL. Lehninger's Principles of Biochemistry. 4th ed. New York, New York: W. H. Freeman and Company, 2005.
- Dobson, CM. In: Pain RH (ed.). Mechanisms of Protein Folding. Oxford, Oxfordshire: Oxford University Press, 2000. 1–28 pp. ISBN 0-19-963789-X
- Pauling, L. (1951). "The structure of proteins: two hydrogen-bonded helical configurations of the polypeptide chain" (PDF). Proceedings of the National Academy of Sciences U.S.A. 37 (5): 235–40. DOI:10.1073/pnas.37.5.235. PMID 14834145. Bibcode: 1951PNAS...37..235P.
- Perrett, D. (2007). "From 'protein' to the beginnings of clinical proteomics". Proteomics – Clinical Applications 1 (8): 720–38. DOI:10.1002/prca.200700525. PMID 21136729.
- Plewczyński, D. (2009). "The interactome: predicting the protein–protein interactions in cells". Cellular & Molecular Biology Letters 14 (1): 1–22. DOI:10.2478/s11658-008-0024-7. PMID 18839074.
- Radzicka, A. (1995). "A proficient enzyme". Science 267 (5194): 90–93. DOI:10.1126/science.7809611. PMID 7809611. Bibcode: 1995Sci...267...90R.
- Reynolds, JA. Nature's Robots: A History of Proteins (Oxford Paperbacks). New York, New York: Oxford University Press, 2003. p. 15. ISBN 0-19-860694-X
- Ritchie, DW. (2008). "Recent progress and future directions in protein–protein docking". Current Protein and Peptide Science 9 (1): 1–15. DOI:10.2174/138920308783565741. PMID 18336319.
- Rüdiger, H. (2000). "Medicinal chemistry based on the sugar code: fundamentals of lectinology and experimental strategies with lectins as targets". Current Medicinal Chemistry 7 (4): 389–416. DOI:10.2174/0929867003375164. PMID 10702616.
- Samarin, S. (2009). "Regulation of epithelial apical junctional complex by Rho family GTPases". Frontiers in bioscience: a journal and virtual library 14 (14): 1129–42. DOI:10.2741/3298. PMID 19273120.
- Sanger, F. (1949). "The terminal peptides of insulin". Biochemical Journal 45 (5): 563–74. PMID 15396627.
- Sankaranarayanan, R. (2001). "The fidelity of the translation of the genetic code". Acta Biochimica Polonica 48 (2): 323–35. PMID 11732604.
- Scheraga, HA. (2007). "Protein-folding dynamics: overview of molecular simulation techniques". Annual Review of Physical Chemistry 58: 57–83. DOI:10.1146/annurev.physchem.58.032806.104614. PMID 17034338. Bibcode: 2007ARPC...58...57S.
- Schwarzer, D. (2005). "Protein semisynthesis and expressed protein ligation: chasing a protein's tail". Current Opinion in Chemical Biology 9 (6): 561–69. DOI:10.1016/j.cbpa.2005.09.018. PMID 16226484.
- Setubal, João; Meidanis, João. Introduction to Computational Molecular Biology: edição=. Boston: PWS Publishing Company, 1997. Capítulo: 8: Molecular Structure Predition. ISBN 0-534-95262-3
- Sharma, Kal Renganathan. Bioinformatics. Nova Iorque: McGraw-Hill, 2009. ISBN 978-0-07-159306-9
- Sleator, RD.. (2012). "Prediction of protein functions". Methods in Molecular Biology 815: 15–24. DOI:10.1007/978-1-61779-424-7_2. PMID 22130980.
- Standley, DM. (2008). "Protein structure databases with new web services for structural biology and biomedical research". Briefings in Bioinformatics 9 (4): 276–85. DOI:10.1093/bib/bbn015. PMID 18430752.
- Stepanenko, OV. (2008). "Fluorescent proteins as biomarkers and biosensors: throwing color lights on molecular and cellular processes". Current Protein & Peptide Science 9 (4): 338–69. DOI:10.2174/138920308785132668. PMID 18691124.
- Sumner, JB. (1926). "The isolation and crystallization of the enzyme urease. Preliminary paper" (PDF). Journal of Biological Chemistry 69 (2): 435–41.
- Tarnopolsky, MA; Atkinson SA, MacDougall JD, Chesley A, Phillips S, Schwarcz HP. (1992). "Evaluation of protein requirements for trained strength athletes". Journal of Applied Physiology 73 (5). PMID 1474076.
- Terpe, K. (2003). "Overview of tag protein fusions: from molecular and biochemical fundamentals to commercial systems". Applied Microbiology and Biotechnology 60 (5): 523–33. DOI:10.1007/s00253-002-1158-6. PMID 12536251.
- EBI (20 de janeiro de 2010). The Catalytic Site Atlas at The European Bioinformatics Institute.
- Walian, P. (2004). "Structural genomics of membrane proteins". Genome Biology 5 (4). DOI:10.1186/gb-2004-5-4-215. PMID 15059248.
- Walker, JH coauthor=Wilson K. Principles and Techniques of Practical Biochemistry. Cambridge, UK: Cambridge University Press, 2000. 287–89 pp. ISBN 0-521-65873-X
- Xiang, Z. (2006). "Advances in homology protein structure modeling". Current Protein and Peptide Science 7 (3): 217–27. DOI:10.2174/138920306777452312. PMID 16787261.
- Yuste, R. (2005). "Fluorescence microscopy today". Nature Methods 2 (12): 902–904. DOI:10.1038/nmeth1205-902. PMID 16299474.
- Zagrovic, B. (2002). "Simulation of folding of a small alpha-helical protein in atomistic detail using worldwide-distributed computing". Journal of Molecular Biology 323 (5): 927–37. DOI:10.1016/S0022-2836(02)00997-X. PMID 12417204.
- Zhang, C. (2003). "Overview of structural genomics: from structure to function". Current Opinion in Chemical Biology 7 (1): 28–32. DOI:10.1016/S1367-5931(02)00015-7. PMID 12547423.
- Zhang, Y. (2005). "The protein structure prediction problem could be solved using the current PDB library". Proceedings of the National Academy of Sciences U.S.A. 102 (4): 1029–34. DOI:10.1073/pnas.0407152101. PMID 15653774. Bibcode: 2005PNAS..102.1029Z.
- Zhang, Y. (2008). "Progress and challenges in protein structure prediction". Current Opinion in Structural Biology 18 (3): 342–48. DOI:10.1016/j.sbi.2008.02.004. PMID 18436442.
- Zhou, ZH. (2008). "Towards atomic resolution structural determination by single-particle cryo-electron microscopy". Current Opinion in Structural Biology 18 (2): 218–28. DOI:10.1016/j.sbi.2008.03.004. PMID 18403197.
- Branden, C; Tooze, J. Introduction to Protein Structure. Nova Iorque: Garland Pub, 1999. ISBN 0-8153-2305-0
- Murray, RF. Harper's Illustrated Biochemistry. Nova Iorque: Lange Medical Books/McGraw-Hill, 2006. ISBN 0-07-146197-3
- Van Holde, KE. Biochemistry. Menlo Park, California: Benjamin/Cummings Pub. Co., Inc, 1996. ISBN 0-8053-3931-0
- Voet, D; Voet JG. Biochemistry. 3ª ed. Hoboken: Wiley, 2004. vol. 1. ISBN 978-0470917459</ref>
- Berg, JM; Tymoczko JL, Stryer L. Biochemistry. 5 ed. Nova Iorque: W H Freeman, 2002.
- Lubert Stryer, Jeremy Mark Berg, John L. Tymoczko (trad. Serge Weinman), Biochimie, Flammarion, « Médecine-Sciences », Paris, 2003, 5ª éd. ISBN 2-257-17116-0.
- Carl-Ivar Brändén, John Tooze (trad. Bernard Lubochinsky, préf. Joël Janin), Introduction à la structure des protéines, De Boeck Université, Bruxelles, 1996 ISBN 2-804-12109-7.
- Rodríguez, Faride. La estructura de las proteínas
- Lehninger, Albert L. Princípios da bioquímica
- Hermann, Janice R.. (1995). "Protein and the Body". Oklahoma Cooperative Extension Service, Division of Agricultural Sciences and Natural Resources • Oklahoma State University: T–3163–1 – T–3163–4.
- Genton, Laurence; Melzer, Katarina; Pichard, Claude. (2010). "Energy and macronutrient requirements for physical fitness in exercising subjects". Clinical Nutrition 29 (4): 413–423. DOI:10.1016/j.clnu.2010.02.002. PMID 20189694.
- Food and Nutrition Board. A Report of the Panel on Macronutrients, Subcommittees on Upper Reference Levels of Nutrients and Interpretation and Uses of Dietary Reference Intakes, and the Standing Committee on the Scientific Evaluation of Dietary Reference Intakes. [S.l.]: THE NATIONAL ACADEMIES PRESS, Washington, D.C., 2005. ISBN 0-309-08537-3
- IOC, Nutrition Working Group of the International Olympic Committee. (2003). "".
- Vernon, Young; Peter Pellett. (1994). "Plant proteins in relation to human protein and amino acid nutrition". American Journal of Clinical Nutrition 59 p. 1203S-l2S.
- Steinke, Waggle. New protein foods in human health: nutrition, prevention and therapy. [S.l.]: CRC Press, 1992. ISBN 978-0-8493-6904-9
- FAO. Amino acid content of foods and biological data on proteins (FAO nutritional studies number 24). [S.l.]: Food and Agriculture Organization, 1985. ISBN 92-5-001102-4
- Latham, Michael C.. Human nutrition in the developing world. [S.l.]: Food and Agriculture Organization of the United Nations, 1997.
- Ten Have, GA; Engelen MP, Luiking YC, Deutz NE.. (2007). "Absorption Kinetics of Amino Acids, Peptides, and Intact Proteins". International Journal of Sport Nutrition and Exercise Metabolism 17: S23–S36. PMID 18577772.
- Food and Nutrition Board. A Report of the Panel on Macronutrients, Subcommittees on Upper Reference Levels of Nutrients and Interpretation and Uses of Dietary Reference Intakes, and the Standing Committee on the Scientific Evaluation of Dietary Reference Intakes. Washington, D.C.: The National Academies Press, 2005. ISBN 0-309-08537-3
- Elliott, Paul; Stamler, Jeremiah; Dyer, Alan R.; Appel, Lawrence; Dennis, Barbara; Kesteloot, Hugo; Ueshima, Hirotsugu; Okayama, Akira; Chan, Queenie; Garside, Daniel B.; Beifan, Zhou. (2006). "Association between protein intake and blood pressure: the INTERMAP Study". Archives of Internal Medicine 166 (1). DOI:10.1001/archinte.166.1.79. PMID 16401814.
- Otten, Jennifer J.; Jennifer Pitzi Hellwig, Linda D. Meyers. Dietary Reference Intake: The Essential Guide to Nutrient Requirements. [S.l.]: Institute of Medicine of the National Academies, 2006. ISBN 0-309-10091-7
- USDA. Infant Nutrition and Feeding. [S.l.]: United States Department of Agriculture, 2009.
- biology-online.org (s. d.). Tertiary Structure. Página visitada em 8 de agosto de 2014.
- biology-online.org Dictionary (s. d. b). Quaternary Structure. Página visitada em 8 de agosto de 2014.
- Evert, Alison (2009). Protein in diet.
- Organização Mundial de Saúde (2007). Protein and amino acid requirements in human nutrition. Página visitada em 8 de julho de 2008.
- Institute of Medicine (2005). Dietary reference intakes: macronutrients. Página visitada em 18 de maio de 2008.
- EFSA (2012). EFSA sets population reference intakes for protein. Página visitada em 2 de setembro de 2014.
Ligações externas
Bases de dados e projetos
- Research Collaboratory for Structural Bioinformatics - Protein Data Bank (ver também Molecule of the Month: pequenos artigos sobre proteínas selecionadas entre a base de dados)
- Protein Databank in Europe (ver também PDBeQuips: pequenos artigos e tutoriais sobre estruturas notáveis)
- NCBI Entrez Protein database
- NCBI Protein Structure database
- Human Protein Atlas
- The Protein Naming Utility
- Human Protein Reference Database
- Human Proteinpedia
- Folding@Home, Universidade de Stanford
- Comparative Toxicogenomics Database: base de dados de interações proteína-químicos, assim como relações entre genes/proteínas e doenças e relações entre químicos e doenças.
- Bioinformatic Harvester: metamotor de pesquisa (29 bases de dados) de informação sobre genes e proteínas.
- Proteopedia – Life in 3D: modelos 3D que podem ser rodados e ampliados, com anotações wiki para cada estrutura molecular proteica.
- UniProt the Universal Protein Resource
- neXtProt – Exploring the universe of human proteins: base de conhecimento sobre proteínas humanas
- MOPED Multi-Omics Profiling Expression Database: dados sobre proteínas/genes humanos e modelo
Nutrição
- Tabela nutricional com quantidade de proteína por cada 100g de alimento, Departamento de Agricultura dos Estados Unidos


![Entre as principais fontes animais de proteína estão o leite materno, a fórmula infantil, carne, peixe, aves de criação, gema de ovo, queijo, iogurte e legumes.[4]](http://upload.wikimedia.org/wikipedia/commons/thumb/5/57/Chickens_in_market.jpg/330px-Chickens_in_market.jpg)



Nenhum comentário:
Postar um comentário