Ligação peptídica
Origem: Wikipédia, a enciclopédia livre.
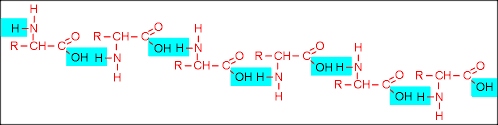
Uma ligação peptídica é uma ligação química que ocorre entre duas moléculas quando o grupo carboxilo de uma molécula reage com o grupo amina de outra molécula, liberando uma molécula de água ( H2O ). Isto é uma reação de síntese por desidratação que ocorre entre moléculas de aminoácidos.
A ligação covalente C-N resultante é chamada ligação peptídica e a grupo funcional resultante é uma amida . Polipeptídeos e proteínas são cadeias de aminoácidos presas por ligações peptídicas. A espinha dorsal do PNA ( quimicamente similar ao DNA e RNA) também é mantido por este tipo de ligação.
A ligação C-N tem um caráter parcial de dupla ligação, com o átomo de N alcançando uma carga positiva parcial e o O uma carga negativa parcial, não permitindo que a molécula normalmente gire sobre esta ligação. O arranjo inteiro dos quatro átomos C,O,N,H da ligação peptídica assim como os dois carbonos vicinais da ligação é uma estrutura planar. Esta ordenação planar rígida é o resultado da estabilização por ressonância da ligação peptídica. Por isso, o esqueleto resultante é uma série de planos sucessivos separados por grupos metilenos substituidos. Isso impõem restrições importantes no número de conformações que uma proteína pode adotar. O Nitrogenio faz apenas 3 ligaçoes covalentes , mas carrega uma molecula de hidrogenio parcialmente , sendo desprotonado na ligaçao pepitidica , formando com a hidroxila a molecula de H2O
Uma ligação peptídica pode ser quebrada por hidrólise ( adição de água ). Em determinadas condições e na presença de água, ocorre a quebra destas ligações espontaneamente com libertação de aproximadamente 10 Kj/mol de energia livre, porém o processo é extremamente lento. Em organismos vivos, o processo é facilitado pelas enzimas. Os organismos vivos também empregam enzimas para formar os peptídeos; este processo requer energia. O comprimento de onda de absorção para uma ligação peptídica é de 220-280 nm.
A ligação covalente C-N resultante é chamada ligação peptídica e a grupo funcional resultante é uma amida . Polipeptídeos e proteínas são cadeias de aminoácidos presas por ligações peptídicas. A espinha dorsal do PNA ( quimicamente similar ao DNA e RNA) também é mantido por este tipo de ligação.
A ligação C-N tem um caráter parcial de dupla ligação, com o átomo de N alcançando uma carga positiva parcial e o O uma carga negativa parcial, não permitindo que a molécula normalmente gire sobre esta ligação. O arranjo inteiro dos quatro átomos C,O,N,H da ligação peptídica assim como os dois carbonos vicinais da ligação é uma estrutura planar. Esta ordenação planar rígida é o resultado da estabilização por ressonância da ligação peptídica. Por isso, o esqueleto resultante é uma série de planos sucessivos separados por grupos metilenos substituidos. Isso impõem restrições importantes no número de conformações que uma proteína pode adotar. O Nitrogenio faz apenas 3 ligaçoes covalentes , mas carrega uma molecula de hidrogenio parcialmente , sendo desprotonado na ligaçao pepitidica , formando com a hidroxila a molecula de H2O
Uma ligação peptídica pode ser quebrada por hidrólise ( adição de água ). Em determinadas condições e na presença de água, ocorre a quebra destas ligações espontaneamente com libertação de aproximadamente 10 Kj/mol de energia livre, porém o processo é extremamente lento. Em organismos vivos, o processo é facilitado pelas enzimas. Os organismos vivos também empregam enzimas para formar os peptídeos; este processo requer energia. O comprimento de onda de absorção para uma ligação peptídica é de 220-280 nm.
Índice
Formação da ligação peptídica
A ligação é o resultado da reação entre a função ácido carboxílico (COOH) com a amina (NH2), como um produto secundário com uma molécula de água (H2O) A ligação peptídica é fundamental na formação de péptidos , de polipéptidos e de proteínas . Após a formação da ligação peptídica, uma extremidade transporta um grupo amina livre - o N - ou de terminal amino e o outro um grupo carboxilo - o C - ou carboxilo-terminal. 1Configurações da ligação peptídica
A ligação peptídica pode existir em duas configurações: cis e trans . No entanto, na forma cis, as cadeias laterais dos átomos de carbono de resíduos adjacentes, interferem uns com os outros, porque ocorre impedimento estereoquímico, a razão cis / trans é da ordem de 1:1000. Uma notável exceção a esta regra é a prolina, onde a forma atípica do grupo lateral faz com que a configuração cis seja mais acessível . 2Propriedades da ligação peptídica
- Estabilidade
- Os comprimentos e ângulos
4
Referências
- The Chemical News , julho de 2002
- The Chemical News , julho de 2002
- The Chemical News , julho de 2002
- The Chemical News , julho de 2002

Nenhum comentário:
Postar um comentário